Polaridad del agua.
 |
INTRODUCCIÓN |
El agua, Sustancia líquida sin olor, color ni sabor que se encuentra en la naturaleza en estado más o menos puro formando ríos, lagos y mares, ocupa las tres cuartas partes del planeta Tierra y forma parte de los seres vivos; está constituida por hidrógeno y oxígeno (H2 O).
La Tierra se caracteriza por contener un alto porcentaje de su superficie cubierta por agua líquida, aunque el volumen total ocupado por el agua no llega a los 1 400 000 000 km3, pequeño comparado con el del planeta. Este volumen se mantiene constante gracias al ciclo hídrico.
El agua es un elemento de la naturaleza, integrante de los ecosistemas naturales, fundamental para el sostenimiento y la reproducción de la vida en el planeta ya que constituye un factor indispensable para el desarrollo de los procesos biológicos que la hacen posible.
En breve te describiré aspectos relacionados con la polaridad de agua, aportándote ejemplos gráficos y audiovisuales.
MARCO TEÓRICO
¿Porque el agua es fundamental para la vida?
Desde hace mucho tiempo se reconocen su estabilidad química, sus notables propiedades como solvente y su participación como reactivo bioquímico. Lo que no se ha apreciado en gran medida es la función crucial de la hidratación (la interacción no covalente de las moléculas de agua con los solutos) en la arquitectura, la estabilidad y la dinámica funcional de macro moléculas como las proteínas y los ácidos nucleicos.
Ahora se sabe que el agua es un componente indispensable de procesos biológicos tan diversos como el plegamiento de proteínas y el reconocimiento biomolecular en mecanismos de transducción de señales, el autoensamble de estructuras supramoleculares como los ribosomas, y la expresión génica. A fin de entender cuán esencial es el agua para los procesos de la vida es necesario revisar su estructura molecular y las propiedades físicas y químicas que resultan de esta estructura.
Estructura Molecular del Agua
La molécula de agua (H20) está formada por dos átomos de hidrógeno y uno de oxígeno. El agua tiene una geometría tetraédrica debido a que su átomo de oxígeno tiene una hibridación Sp3. En el centro del tetraedro se encuentra el átomo de oxígeno. Dos de las esquinas están ocupadas por átomos de hidrógeno, cada uno de los cuales está unido al átomo de oxígeno por un enlace covalente sencillo (Figura 1). Las otras dos esquinas están ocupadas por los pares de electrones sin compartir el oxígeno. El oxígeno es más electronegativo que el hidrógeno (el oxígeno tiene una capacidad mayor para atraer electrones cuando está unido al hidrógeno). Como consecuencia, el átomo de oxígeno más grande lleva una carga negativa parcial (0- ) y cada uno de los dos átomos de hidrógeno lleva una carga positiva parcial (0+) (Figura 2).
La distribución electrónica de los enlaces oxígeno-hidrógeno se desplaza hacia el oxígeno y, por lo tanto, el enlace es polar. Si las moléculas de agua fueran lineales, como las del dióxido de carbono (O =C=O), las polaridades de los enlaces se equilibrarían entre sí y el agua sería no polar. Sin embargo, las moléculas de agua están dobladas con un ángulo de enlace de 104.5°, un poco menor que el ángulo de un tetraedro simétrico, de 190°.
Figura 1. Estructura tetraédrica del agua.
En el agua, dos de los cuatro orbitales Sp3 del oxígeno están ocupados por dos pares solitarios de electrones. Cada uno de los otros dos orbitales Sp3 semillenos se llena con la adición de un electrón del hidrógeno.
Figura 2. Cargas de una molécula de agua.
Los dos átomos de hidrógeno de cada molécula llevan cargas positivas parciales. El átomo de oxígeno lleva una carga negativa parcial.
Polaridad del agua
Una molécula polar es aquella que presenta un solo negativo y un polo positivo, es decir, que esta eléctricamente cargada.
El O tiene carga negativa y los H tienen carga positiva.
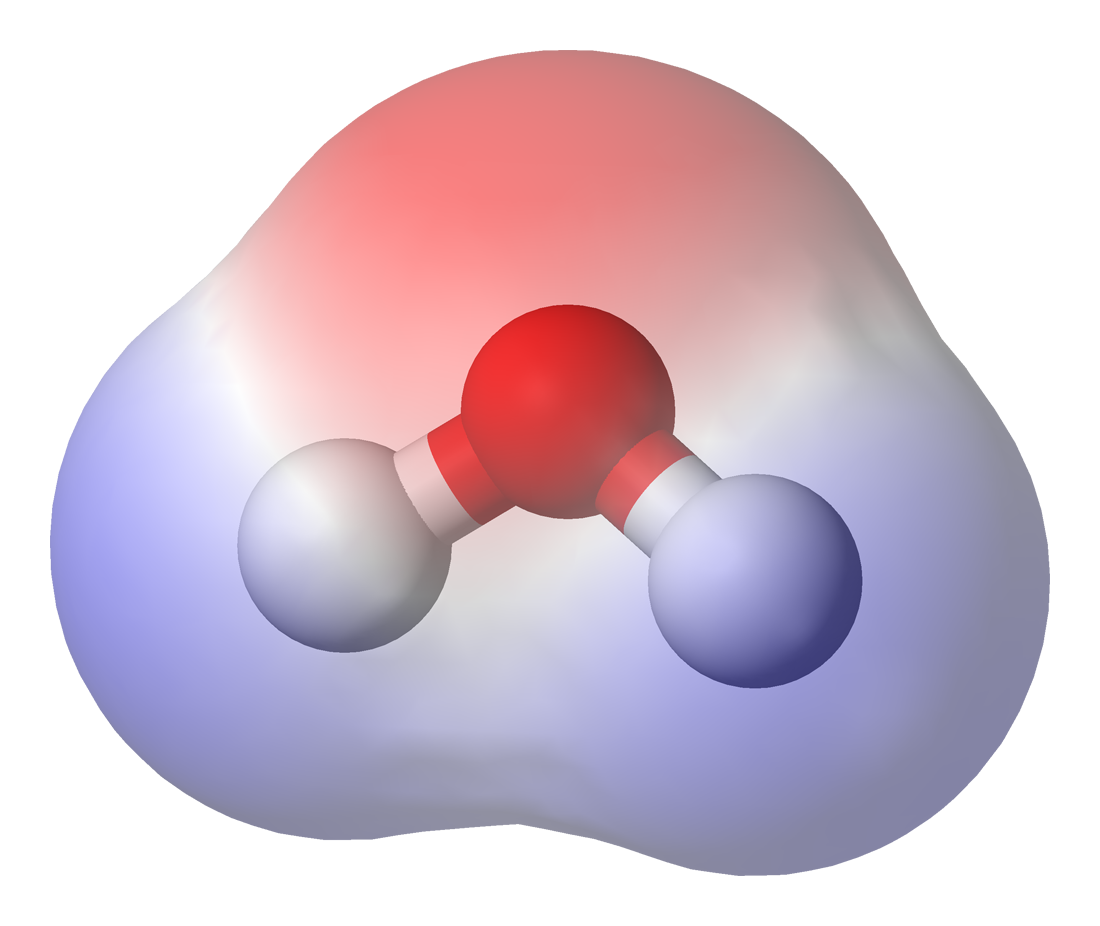
Figura 3. Muestra un ejemplo a escala molecular como se distribuye la electronegatividad de la partícula de agua.
Los electrones en los átomos de hidrógeno del agua son fuertemente atraídos por el átomo de oxigeno y están, en realidad, más serca del núcleo del oxigeno que de los del hidrógeno. por esto, la molécula de agua tiene una carga negativa en el centro (color rojo) y una carga positiva en sus extremos (tono verde). Por eso la molécula de agua es polar. ademas, la carga neta de una molécula de agua es de cero.
El átomo de oxigeno, con ocho protones en su núcleo, atrae con mayor fuerza a los electrones del enlace que el átomo de hidrógeno, es decir, es mas electronegativo que el átomo de hidrógeno, que por lo que la nube electrónica del enlace esta deforme y forma un dipolo permanente. O sea, esta separación de carga que produce un dipolo permanente, tiene una parte negativa que apunta al átomo de O y una parte positiva que se encuentra en la bisectriz del angulo formando por los enlaces H-O-H.
Esta separación de la parte positiva y negativa de la molécula, permite reacciones ácido-base que son fundamentales para las funciones de las proteínas y de los ácidos nucleicos. Ah continuación te enlazo un vídeo donde unos estudiantes realizan un experimento con relación a la polaridad del agua.



No hay comentarios:
Publicar un comentario